号頭言 「思いがけない結果」
大阪大学大学院医学系研究科内科学(内分泌・代謝内科)
池上 博司
私が大学院に入り、国内で開催された国際シンポジウムで初めての英語発表をしたそのシンポジウムで、1型糖尿病のモデル動物NOD(nonobese diabetic)マウス樹立に関する発表があった。私とNODマウスの最初の邂逅である。NODマウスはクローズドコロニー(遺伝的に不均一な集団)であるJcl:ICRマウスから選択高配によって近交系(遺伝的に均一な系統のこと)化された。何を指標として選択高配されたか?高血糖である。糖尿病の専門家であれば、高血糖を指標として1型糖尿病のモデルが選択高配できるとは考えない。2型糖尿病は境界型を経て糖尿病へと連続的に血糖が上昇するから、血糖値をスクリーニングすれば糖尿病モデルに近づくかもしれないが、急性発症する1型糖尿病を軽度の高血糖を示す動物のなかから抽出する確率は、正常血糖の動物から抽出する場合とほとんどかわりないと考えられるからである。実は、NODマウス生みの親である牧野進博士も1型糖尿病のモデルをつくろうと思って選択高配を進めていたのではなかった。
NODマウスの元となったのは白内障を自然発症するマウス(CTSマウス)である。白内障は糖尿病に合併することが多いから、このマウスから2型糖尿病のモデル動物が姉妹系統として分離できるのではないかという予想のもとに、血糖が比較的高い系統を分離して選択高配する試みがスタートした。コントロール系統も必要だろうと血糖が正常な系統の選択交配も同時に開始された。残念ながら血糖が高めのラインからは何世代交配を重ねても糖尿病を発症する動物は得られなかった。ところが思いがけないことに、コントロール系統として近交系化を進めていた正常血糖ラインの中に顕性糖尿病を発症する動物が見いだされたのである。正常血糖から突然発症したことから予想される通り、この動物の糖尿病は1型糖尿病であり、これを系統化したのが現在繁用されているNODマウスである。はからずも、目指した2型ではなく1型糖尿病のモデルが確立された訳だが、思いがけず樹立されたこのNODマウスが1型糖尿病研究にもたらした目覚ましい進歩・貢献は周知の通りである。
高血糖を指標に選択交配されていたもう一方の系統は、NODマウスが見いだされたことで血糖による選択は中止されたが系統維持は継続され、NODのコントロール系統NON(nonobese normal)マウスとなった。しかし、高血糖を指標に選択交配がなされていた経緯から想像されるようにNONマウスの耐糖能は名前とは裏腹に“normal”ではなく、糖負荷試験を行うと耐糖能低下を認める。選択交配が途中までで中断したので耐糖能低下が完全に固定されたモデルとは言い難いが、1型糖尿病のモデルNODマウスの姉妹系統に耐糖能低下を示す系統が存在することは間違いない。
CTSマウスから糖尿病ラインの分離が開始されたちょうど同じ頃、名古屋大学助教授をなさっていた柴田昌雄博士は牧野進博士の維持しておられたコロニーからJcl:ICRマウスの分与を受けて、耐糖能を指標とした選択交配による糖尿病モデルマウスの樹立に着手された。その後の選択交配を経て確立されたのが2型糖尿病のモデルNSYマウスである。即ち、2型糖尿病モデルのNSYマウスはNODと同じ祖先に由来する近縁系統なのである。このようにみてくると、1型糖尿病のモデルNODマウスの周辺には耐糖能低下(NON)や2型糖尿病(NSY)を示す関連系統が散見されることがわかる。ヒト1型糖尿病の家族歴にも2型糖尿病が多いことは内外で報告されている。両者を勘案すると、1型糖尿病の関連系統に2型糖尿病の病態を認めることもあながち偶然ではないように思える。同じ祖先のJcl:ICRという不均一な集団に含有されていた遺伝子の一部が、1型・2型両糖尿病の系統に遺伝して、両病型に共通する遺伝子として作用している可能性はないだろうか?モデル動物とヒトの両者で糖尿病の遺伝解析を進めてきた筆者の長年の仮説である。1型糖尿病は膵β細胞に対する自己免疫、2型糖尿病はインスリン抵抗性とそれを代償するには足りない相対的インスリン分泌低下、と両者の成因が異なることは百も承知である。HLAに代表される1型糖尿病特有の遺伝子、インスリン分泌や抵抗性の量的変化に関与する2型糖尿病特有の遺伝子が存在することも間違いないだろうし、HLAのような主効果遺伝子が1型・2型に共通する主要遺伝子として作用しているなど考えているのでもない。多因子疾患である糖尿病の複数存在する遺伝子のうちの一部が1型・2型両者に共通する遺伝素因として作用し、それに1型特有の遺伝子(免疫調節遺伝子の異常など)が加われば1型糖尿病、2型特有の遺伝子(インスリン抵抗性遺伝子など)が加われば2型糖尿病を発症する、そのような仮説である(1)。この夢のような話が少しずつ現実味を帯びるエビデンスが最近の研究で見いだされている。思いがけない経緯で樹立された1型糖尿病モデルNODマウスから、さらに思いがけない結果が生まれるかも知れない。詳細は別の機会のお楽しみにおいておきましょう。
1)Ikegami H et al.: Mouse models of type 1 and type 2 diabetes derived from the same closed colony: genetic susceptibility shared between two types of diabetes? ILAR Journal 45:267-276, 2004
第20回日本糖尿病動物研究会年次学術集会の開催にあたって
共立女子大学家政学部臨床栄養学研究室
井上 修二
このたび第20回日本糖尿病動物研究会年次学術集会を平成18年2月9日(木)、10日(金)に共立女子大学キャンパスを会場として開催のお世話をさせていただくことになりました。歴史と伝統ある本研究会を開催させていただくことを、大変光栄に思っております。最近の糖尿病研究の進歩は著しいものがあり、動物モデルを用いた研究においても新しい知見が積み重なり、その研究成果が日常臨床へと応用されつつあります。
糖尿病モデル動物を介して糖尿病の病態生理およびその応用の研究を行なう研究会は国際的にもユニークなもので年次学術集会を有するのはわが国だけではないかと思われます。そのため、本研究の一層の発展に努力することが学会長としての役割かと胆に命じております。
第20回にあたる本研究会は節目の学術集会であり、最近の糖尿病動物研究の進歩をとり入れるべく特別講演1、イブニングセミナー1、シンポジウム2、ワークショップ2を企画し2日目も夕方までのプログラムを組ませていただきました。特にワークショップ2「糖尿病遺伝子改変動物―病因、病態と治療」は公募とさせていただき、今までに本研究会や他の学術集会において既に発表された報告の集大成の発表をしていただくよう企画しました。会員の先生方には今まで発表されたテーマで今回まとめて発表されますよう積極的に応募してくださるようお願い致します。勿論未発表のものでも結構です。
第20回本研究会が会員および関係の方々のご協力で新しい飛躍の会になるよう念じております。
賛助会員の研究(7)マウス、ラットの摂食リズム
三菱ウェルファーマ株式会社創薬第二研究所
坂井 薫
哺乳類における体内時計は視床下部交差上核(SCN)にあり行動や代謝について約24時間周期の概日リズムを作っている。この概日リズムの分子機構は精神疾患に加え代謝疾患にも重要な役割を持つ。
C57BL/6Jマウスは摂食や体内時計の正常なコントロール動物として概日リズムが研究されている。C57BL/6Jマウスでは暗期の直前から活動量が亢進し暗期直後1-2時間にかけてピークを迎え、暗期の終わりにも第二の活動ピークが見られることが報告されている。また、明期ではほとんどの時間帯で活動が低下することが知られている。C57BL/6Jマウスの摂食パターンは活動パターンと良く一致しており、暗期直後1-2時間と暗期の終わり前にそれぞれピークが観察され、明期にはほとんどの時間帯で摂食行動が低下した(図1)。一方、レプチン受容体に異常がある肥満・糖尿病を呈するdb/dbマウスの摂食は異なる概日パターンを示した。まず暗期、明期を通じて単位時間当たりの摂餌量が増加し、特にC57BL/6Jマウスでは低下がみられた明期でも摂食行動が継続的に観察された。暗期ではやはり摂食行動が亢進するとともに明確な摂食行動のピークパターンが見られなくなることが特徴的であった(図1)。
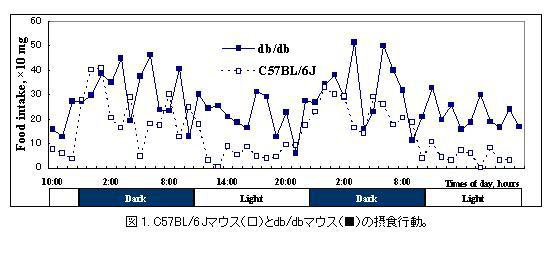
db/dbマウスと同様レプチン受容体に異常がある肥満・インスリン抵抗性を呈するZucker-fattyラット(fa/fa)も摂食行動の異常を示した(図2)。正常なSDラットに較べ、Zuckerラットでは単位時間当たりの摂食量が亢進し、特に明期で顕著な摂食行動の亢進が観察された。暗期では摂食量の亢進が見られたが摂食行動はdb/dbマウスとは異なりSDラットと比較的似たパターンを保持していた。同腹の野生型Zucker leanラット(+/+)に較べZucker-fattyラットは基礎代謝率が14 ml/kg0.75/minから12ml/kg0.75/minに低下していた。
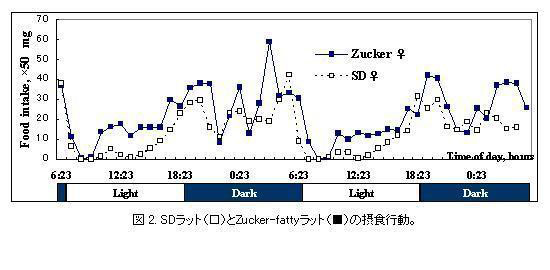
このような実験動物における摂食行動の概日パターンは現在では良く知られたものであり、機器の進歩で分単位での経時測定が可能になっている。また、Pair-Feedingで実験的に摂食量の影響を取り除いた系で摂食以外の生理作用やそのパターンを解析することも可能となっている。これらの基礎データをもとに中枢における摂食行動に関わる神経支配や、神経伝達物質の摂餌行動・代謝におよぼす影響の詳細な解析が進展し、さらに新規な遺伝子ターゲットの探索への応用も精力的に行われている。


